近日,深圳市禾沐基因生物技术有限责任公司(以下简称禾沐基因)与玛希隆大学(Mahidol University)的旗下Siriraj医院合作开展的HGI-001注射液治疗输血依赖型β地中海贫血的临床试验在泰国取得重大进展:其核心产品HGI-001注射液正式获得泰国食品药品监督管理局(ThaiFDA)的临床试验批准,核心生产设备已完成落地转移验证,计划由Siriraj医院完成其在泰国的生产制备以及后续治疗。这标志着公司国际化战略迈出关键一步,为东南亚市场开拓及全球业务发展注入强劲动力。
设备3Q验证高标准完成
由华大自主研发的全自动细胞分选仪(Celaxi-23)在泰国生产基地顺利通过安装确认(IQ)、运行确认(OQ)和性能确认(PQ)的完整验证流程,细胞回收率达到99%以上,为后续本地化生产及临床应用奠定坚实基础。
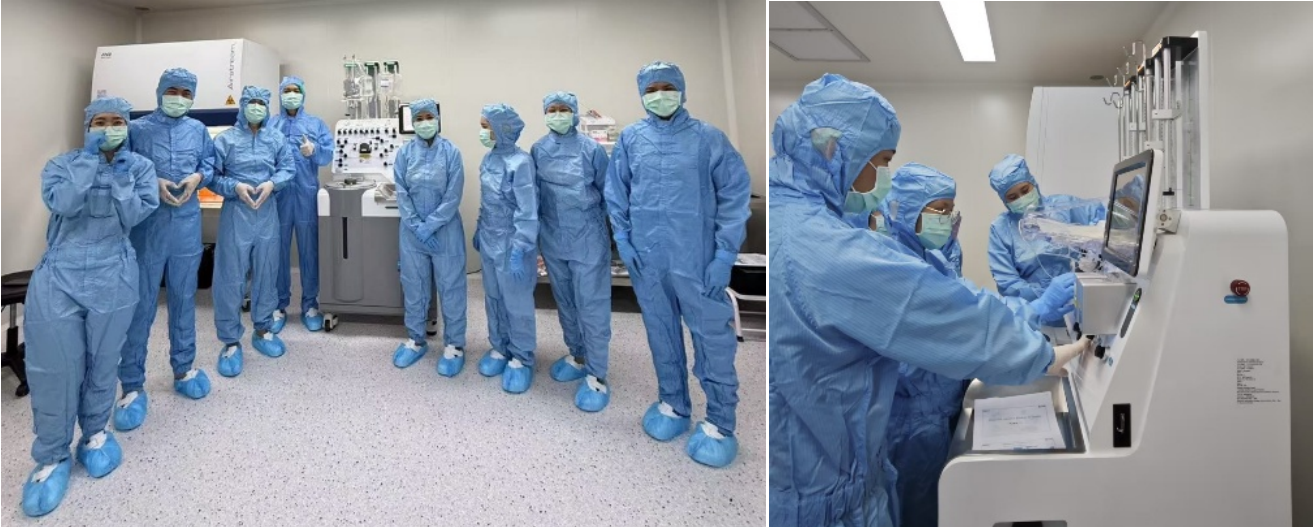
华大研究院设备工程师协助Siriraj技术人员完成生产设备转移验证
ThaiFDA临床试验正式获批
凭借严谨的技术资料与合规性验证,公司成功获得ThaiFDA签发的临床试验许可。此次获批标志着产品安全性与有效性获国际权威认可,为加速东南亚市场准入打通关键环节。
Hemocel (HGI-001注射液)的ThaiFDA临床试验批准通知(泰文原文)
首批配套耗材已顺利出口至泰国合作机构,后续根据临床招募情况按需出口关键试剂,同步开展生产工艺和质量控制转移验证工作,确保本土化生产的稳定性与一致性,为规模化供应提供可靠保障。
|
首批试剂耗材到达泰国曼谷机场由物流公司安排运输至Siriraj实验室
公司还与泰国其他权威医疗机构达成合作意向,并正在接受伦理审查,受试者招募等准备工作有序推进。
此次突破是禾沐基因践行“天下无贫”和产品出海战略的重要里程碑:
技术实力彰显: ThaiFDA审批的高效通过,印证了公司产品的国际竞争力与合规能力。
市场拓展提速:东南亚作为全球医疗需求增长最快的区域之一,此次布局将加速公司辐射东盟市场的进程。
产业链协同深化:从设备验证、耗材出口到本地化生产的全链条闭环,凸显公司在跨境资源整合与产能落地的综合实力。
目前,禾沐基因正紧密筹备泰国临床试验的全面实施,并同步推进东南亚多国注册计划。未来,公司将依托技术优势与国际化团队,持续深化“一带一路”沿线市场布局,以创新驱动全球健康事业发展。
HEMOGEN
禾沐致力于治疗血红蛋白疾病,力求实现天下无“贫”大目标。
秉承“基因科技造福人类”的愿景和使命,通过与深圳华大生命科学研究院及华大其他部门的紧密合作,以及借助华大集团在医疗健康领域的渠道影响力,至今已产出专利成果17项,目前重点开发第一序列产品HGI-001注射液(针对输血依赖型β地中海贫血)IND申报已获批,目前正在筹备开展注册临床试验。
具备独立的研发能力和完善的质量管理体系,拥有慢病毒基因导入和CRISPR/Cas基因编辑两大基因改造技术平台,建有约1000平米GMP厂房、多条在研产品管线及40人+的运营团队,持续专注于基因治疗载体和基因改造技术的研发和应用。
禾沐将持续秉承“基因科技造福人类”和天下无“贫”的使命,为守护重型地贫病患的健康福祉而不懈努力!

